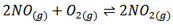اثر تغییر فشار روی جا به جایی تعادل
در درس قبل سه عامل موثر بر جا به جایی تعادل های شیمیایی را نام بردیم و به شرح یک مورد پرداختیم. در ادامه این بحث قصد داریم تاثیراتی را که تغییر فشار بر روی جا به جایی تعادل می گذارد بررسی کنیم و نتایج مختلف آن را ذکر کنیم.
در یک سامانه گازی با تغییر حجم ظرف واکنش، می توان تغییرات فشار را اعمال کرد. به طوریکه با افزایش حجم فشار کم شده و با کاهش حجم فشار زیاد می شود. اگر تغییر فشار باعث بر هم زدن تعادل شود، طبق اصل لوشاتلیه واکنش در جهتی جا به جا می گردد که اثر وارده را خنثی کند تا تعادل برقرار شود.
در یک سامانه گازی که تعداد مول های گازی مواد شرکت کننده در طرفین واکنش با هم متفاوت است، افزایش فشار باعث می شود تعادل به سمت تعداد مول گازی کمتر جا به جا شود و کاهش فشار باعث می شود تعادل به سمت تعداد مول گازی بیشتر پیش رود
افزایش فشار (کاهش حجم):
- با افزایش فشار واکنش در جهت رفت به سمت تعداد مول گازی کمتر جا به جا می شود.
- مقدار NO2(g) زیاد شده و مقدار O2(g) و NO(g) کم می شود.
- با کاهش حجم سامانه غلظت تمامی مواد در تعادل جدید افزایش می یابد. زیرا غلظت=مقدارحجم ، در نتیجه با کاهش مقدار و کاهش حجم، طبق آزمایشات صورت گرفته نسبت مقدار به حجم که همان غلظت است افزایش می یابد.
با افزایش فشار تعداد مولکول های گازی در واحد حجم افزایش یافته و احتمال برخوردهای مولکولی موثر بیشتر می شود در نتیجه سرعت واکنش رفت و سرعت واکنش برگشت زیاد می گردد ولی میزان افزایش سرعت واکنش رفت بیشتر است، به همین دلیل تعادل در جهت رفت جا به جا می شود.
کاهش فشار ( افزایش حجم):
با کاهش فشار واکنش در جهت برگشت به سمت تعداد مول گازی بیشتر جا به جا می شود.
- مقدار NO2(g) کم شده و مقدار O2(g) و NO(g) زیاد می شود.
-
با افزایش حجم سامانه غلظت تمامی مواد در تعادل جدید کاهش می یابد. زیرا غلظت=مقدار تقسیم بر حجم ، در نتیجه با افزایش مقدار و افزایش حجم، طبق آزمایشات صورت گرفته نسبت مقدار به حجم که همان غلظت است کاهش می یابد.
-
با کاهش فشار تعداد مولکول های گازی در واحد حجم کاهش یافته و احتمال برخوردهای مولکولی موثر کمتر می شود در نتیجه سرعت واکنش رفت و سرعت واکنش برگشت کم می شود ولی میزان کاهش سرعت واکنش برگشت کمتر است، به همین دلیل تعادل در جهت برگشت جا به جا می شود.
افزایش فشار 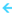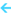 افزایش غلظت کلیه گازها
افزایش غلظت کلیه گازها 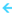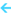 افزایش سرعت واکنش در هر دو جهت
افزایش سرعت واکنش در هر دو جهت
کاهش فشار 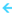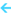 کاهش غلظت کلیه گازها
کاهش غلظت کلیه گازها 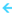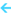 کاهش سرعت واکنش در هر دو جهت
کاهش سرعت واکنش در هر دو جهت
نکته: اگر در یک تعادل، تعداد مول های گازی در دو طرف با یکدیگر برابر باشند، تغییرات فشار بر جا به جایی تعادل بی اثر است؛ اما با افزایش فشار سرعت واکنش رفت و برگشت به یک نسبت زیاد می شود .
سوال: با کاهش فشار در تعادل گازی: 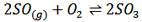 ، کدام گزینه رخ نمی دهد؟
، کدام گزینه رخ نمی دهد؟
1- غلظت O2 و SO2 کم می شود.
2- سرعت واکنش برگشت زیاد می شود.
3- نسبت حاصلضرب غلظت فراورده ها به حاصلضرب غلظت واکنش دهنده ها تغییری نمی کند.
4- مجموع تعداد مول های گازی در سامانه افزایش می یابد.